 Na stránkách učebnice se můžete seznámit s principy acidobazických titrací.
Na stránkách učebnice se můžete seznámit s principy acidobazických titrací.
V rejstříku pojmů rychle najdete vysvětlení pojmu, který vám nebude jasný.
Acidobazické titrace
Acidobazické titrace, jinými slovy také neutralizační odměrná analýza, slouží ke stanovení obsahu vodíkových kationtů ve vzorku.Podstatou stanovení je reakce mezi kyselinou a zásadou. Probíhá-li reakce ve vodném prostředí, jedná se o reakci hydroxoniových kationtů s hydroxidovými anionty za vzniku velmi málo disociovaných molekul vody:
H3O+ + OH- => 2 H2OCož můžeme zjednodušeně zapsat:
H+ + OH- = H2OPři neutralizační odměrné analýze sledujeme změny pH roztoku v průběhu reakce kyseliny a zásady. Změnu pH v závislosti na objemu přidávaného odměrného roztoku znázorňujeme titrační křivkou.
Při neutralizační odměrné analýze rozlišujeme tyto typy reakcí kyselin a zásad:
- reakce silné kyseliny se silnou zásadou
- reakce silné kyseliny se slabou zásadou
- reakce slabé kyseliny se silnou zásadou
- reakce slabé kyseliny se slabou zásadou
Neutralizační odměrná analýza se dělí na acidimetrii a alkalimetrii.
Titraci ukončujeme v bodě ekvivalence, ten určujeme pomocí acidobazických indikátorů. Ze spotřeby odměrného činidla vypočítáme obsah látky ve zkoumaném roztoku.
Stanovení provádíme v titrační aparatuře.
Titrační křivka
Při alkalimetrických a acidimetrických titracích se každým přídavkem odměrného roztoku postupně mění pH titrovaného roztoku. Grafickým znázorněním změny pH při titraci v závislosti na objemu přidaného odměrného roztoku je titrační křivka. Průběh titrační křivky je vždy esovitý, ale její tvar je rozdílný podle síly kyselin a zásad.Reakce silné kyseliny se silnou zásadou
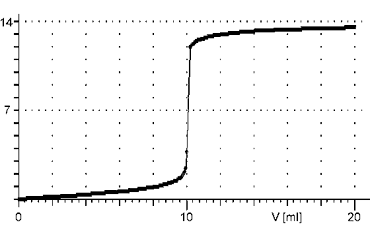
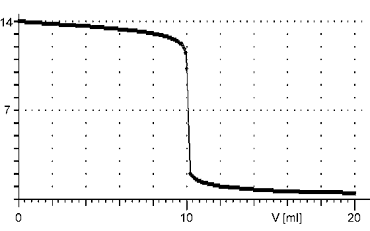
Titrační křivka je charakteristická velmi strmým skokem v těsném okolí bodu ekvivalence po počátečním velmi pomalém růstu. Bod ekvivalence leží při pH = 7 a změna pH vzhledem k přídavku odměrného roztoku je extrémně veliká.
Reakce slabé kyseliny se silnou zásadou
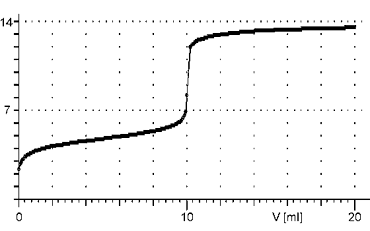
Titrační křivka začíná v méně kyselé oblasti, než je tomu u silných kyselin. Je charakteristická menší změnou pH v okolí bodu ekvivalence.
Reakce slabé zásady se silnou kyselinou
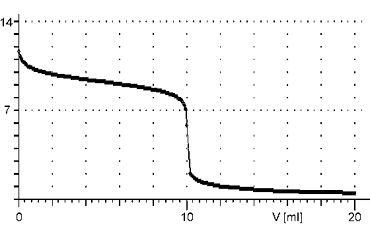
Titrační křivka začíná v méně zásadité oblasti, než je tomu u silných zásad. Je charakteristická menší změnou pH v okolí bodu ekvivalence.
Reakce slabé kyseliny se slabou zásadou
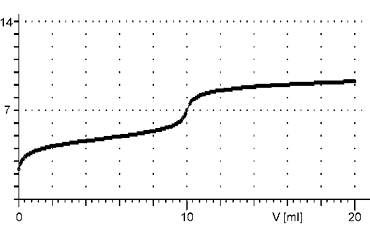
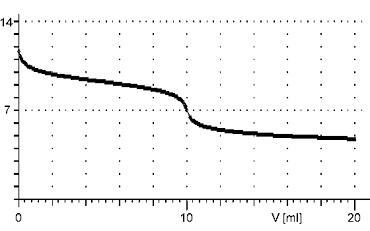
Při titracích slabých kyselin slabou zásadou a naopak je změna pH v okolí bodu ekvivalence velice pozvolná, na titrační křivce se objeví pouze nepatrný skok. Proto tyto titrace nemají praktické uplatnění.
Titrační křivky si můžete sami vykreslit.
Acidimetrie
 Při acidimetrii se stanovují zásady odměrnými roztoky kyselin. Nejčastěji se používají odměrné roztoky kyseliny chlorovodíkové a kyseliny sírové o koncentraci 0,05 až 0,2 mol×dm-3. Ke stanovení přesné koncentrace se používají nejčastěji tyto standardy:
Při acidimetrii se stanovují zásady odměrnými roztoky kyselin. Nejčastěji se používají odměrné roztoky kyseliny chlorovodíkové a kyseliny sírové o koncentraci 0,05 až 0,2 mol×dm-3. Ke stanovení přesné koncentrace se používají nejčastěji tyto standardy:
- hydrogenuhličitan draselný nebo sodný
- uhličitan sodný bezvodý
- dekahydrát tetraboritanu disodného
- šťavelan sodný
Při acidimetrických stanoveních se používají byrety s kohoutkem.
Alkalimetrie
 Při alkalimetrii se stanovují kyseliny odměrnými roztoky zásad. Nejčastěji se používají roztoky hydroxidu sodného a hydroxidu draselného o koncentraci 0,1 a 0,2 mol×dm-3. Základní látkou (standardem) ke stanovení přesné koncentrace titračního činidla je dihydrát kyseliny šťavelové.
Při alkalimetrii se stanovují kyseliny odměrnými roztoky zásad. Nejčastěji se používají roztoky hydroxidu sodného a hydroxidu draselného o koncentraci 0,1 a 0,2 mol×dm-3. Základní látkou (standardem) ke stanovení přesné koncentrace titračního činidla je dihydrát kyseliny šťavelové.Alkalimetricky je možno stanovit silné i slabé kyseliny.
Při alkalimetrických stanoveních se používají byrety s kuličkovým ventilem.
Acidobazické indikátory
Indikátory jsou slabé organické kyseliny nebo zásady. Odevzdáním resp. přibráním protonu přecházejí na konjugovanou formu a tato změna je doprovázena změnou zbarvení. To vystihuje rovnice:HInd (zbarvení A) = H+ + Ind- (zbarvení B)Pozorované zbarvení roztoku závisí na poměru koncentrací ionizované a neionizované formy indikátoru.
Oblast pH, ve které nastává pozorovatelná změna zabarvení indikátoru, se nazývá oblast barevného přechodu indikátoru neboli funkční oblast indikátoru.
Indikátor pro danou titraci volíme především tak, aby oblast jeho barevného přechodu odpovídala pH v okolí bodu ekvivalence na titrační křivce. Následující tabulka obsahuje přehled nejpoužívanějších acidobazických indikátorů:
| Indikátor | Funkční oblast pH | Zbarvení | |
| kyselé formy | zásadité formy | ||
| thymolová modř | 1,2 až 2,8 | červené | žluté |
| methyloranž | 3,1 až 4,5 | červené | žluté |
| methylčerveň | 4,4 až 6,3 | červené | žluté |
| bromthymolová modř | 6,0 až 7,6 | žluté | modré |
| fenolftalein | 8,2 až 10,0 | bezbarvé | červenofialové |
| thymolftalein | 9,3 až 10,5 | bezbarvé | modré |
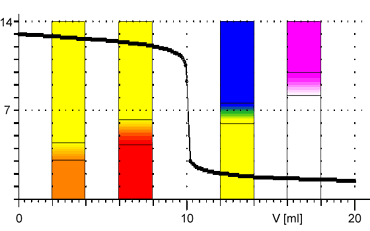
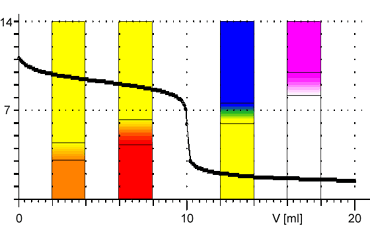
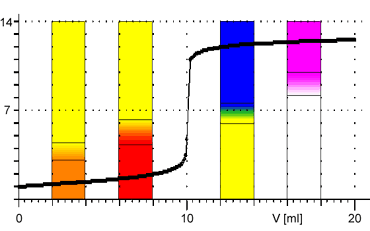
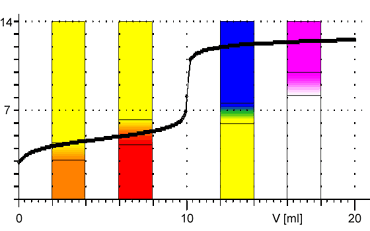
Z obrázků je patrné, že při titraci silných kyselin a zásad můžeme k indikaci bodu ekvivalence použít všechny vyznačené indikátory. Pro titraci slabé zásady jsou vhodnými indikátory methyloranž nebo methylčerveň. Pro titraci slabé kyseliny je vhodným indikátorem fenolftalein.
Výpočet obsahu stanovované látky ve vzorku
Základem pro výpočet obsahu stanovované složky ve vzorku je chemická rovnice. Z té vypočítáme faktor titrace Ft. Faktor titrace je dán poměrem koeficientů stanovované složky a odměrného činidla.Ft = k (s.s.) : k (o.č.)Titrací zjistíme spotřebu odměrného činidla známé koncentrace. Pomocí molární hmotnosti stanovované složky můžeme vypočítat obsah látky ve zkoumaném vzorku. Použijeme vztah:
m = V . c . M . Ftm…hmotnost stanovené látky [g] V…spotřeba odměrného činidla [l] M…molární hmotnost [g.mol-1] Ft…faktor titrace
Rejstřík pojmů
* - takto označené slovo nebo sousloví najdete v rejstříkuAcidobazická titrace viz neutralizační odměrná analýza.
Aciobazické indikátory zde, nebo zde.
Acidobazické indikátory jsou slabé organické kyseliny nebo zásady, které reagují svým zabarvením na změnu molární koncentrace* vodíkových kationtů v roztoku.
Bod ekvivalence
Bod ekvivalence je kvantitativní konec reakce, je to stav, kdy stanovovaná složka právě zreagovala s ekvivalentním množstvím titračního činidla. Tento stav se určuje inikátory*.
Hydroxidové ionty OH-
Uvolňují se rozpouštěním zásad* ve vodě. Reagují s vodíkovými ionty za vzniku vody.
Hydroxoniový ion H3O+
Nazývá se též oxoniový ion. Tvoří se spojením vodíkového iontu s molekulou vody. V roztoku, který obsahuje hydroxidové ionty*, se reakce účastní pouze vodíkové ionty.
Indikátor
Indikátory jsou látky, které reagují s titračním činidlem* v bodě ekvivalence nebo v jeho blízkosti za změny barvy nebo vzniku zákalu. Slouží k určení bodu ekvivalence. Podle použití rozlišujeme indikátory acidobazické*, oxidačně-redukční, srážecí a chelatometrické.
Kvantitativní průběh chemické reakce
Proběhne-li chemická reakce kvantitativně, zreagovala právě chemicky ekvivalentní látková množství* (tj. odpovídající poměru látkových množství vyjádřených chemickou rovnicí) stanovované složky a titračního činidla*. Kvantitativní ukončení reakce se nazývá bod ekvivalence*.
Kyselina
Látka schopná předávat proton jiné látce. Při rozpouštění ve vodě uvolňuje vodíkové ionty* (H+ - protony). Roztoky kyselin mají pH* menší než 7.
Silná kyselina ve vodě úplně ionizuje za vzniku velkého množství vodíkových iontů.
Slabá kyselina ve vodě ionizuje jen částečně. Tedy jen malá část jejích molekul se štěpí na vodíkové ionty a anionty kyseliny.
Látkové množství
Látkové množství je veličina pomocí které můžeme porovnávat množství dvou a více látek. Jeho základní jednotkou je 1 mol. Definici látkového množství najdete v učebnicích obecné chemie.
Molární koncentrace
Udává látkové množství* rozpuštěné v 1 l roztoku. Lze ji vyjádřit vztahem cM = n / V. Její jednotkou je 1 mol.l-1, což se též vyjadřuje symbolem 1M.
Neutralizace
Neutralizace je reakce mezi kyselinou* a zásadou*, při které vzniká voda a sůl příslušné kyseliny. Stejné množství vodíkových a hydroxidových iontů spolu reaguje a vytváří neutrální roztok*. Anion kyseliny a kation zásady produkují sůl.
Neutralizační odměrná analýza (acidobazické titrace)
Tato odměrná analýza využívá pro stanovení reakce mezi kyselinami a zásadami, neboli acidobazické reakce.
Neutrální roztok
Neutrální roztok obsahuje stejné množství vodíkových a hydroxidových iontů a má pH = 7.
Odměrná analýza (titrace)
Odměrnou analýzou se stanovuje obsah určité složky ve vzorku. Podstatou odměrného stanovení je chemická reakce mezi odměrným roztokem* a stanovovanou látkou. Známe přesnou koncentraci odměrného roztoku, který přidáváme k přesně danému objemu vzorku, ve kterém je obsažena stanovovaná látka. Reakce musí proběhnout kvantitativně*, tím dosáhneme bodu ekvivalence*, který indikujeme různými způsoby. Indikace se provádí buď vizuálně, pomocí barevných indikátorů* reagujících na změnu chemického složení, což je velice subjektivní metoda, nebo můžeme použít objektivní instrumentální metody indikace. Podle druhu chemické reakce rozdělujeme odměrnou analýzu na neutralizační*, srážecí, komplexotvornou a oxidačně-redukční.
Odměrný roztok
Roztok o přesné koncentraci, který se přidává ke stanovovanému roztoku o známém objemu až do bodu ekvivalence. Z jeho spotřeby a koncentrace se vypočítá obsah stanovované složky.
pH - vodíkový exponent
pH je jiný způsob vyjádření molární koncentrace* vodíkových iontů v roztoku. Je definováno jako záporný dekadický logaritmus koncentrace vodíkových iontů: pH = - log [H+]
Standard nebo též základní látka
Standardy se používají ke stanovení přesné koncentrace odměrného roztoku*. Jsou to chemikálie čistoty alespoň 99,99% s dobře definovaným a stálým složením.
Titrace neboli odměrná analýza*
Titrační činidlo je totéž co odměrný roztok*.
Titrační křivka
Titrační křivka je grafické znázornění průběhu titrace*. Vyjadřuje závislost změny pH* stanovovaného roztoku na objemu přidávaného titračního činila*.
Vodíkový ion
Vodíkové ionty neexistují v roztoku jako takové, ale poutají molekuly vody za vzniku hydroxoniových iontů*.
Zásada
Zásada je látka schopná přijmout proton. Je schopna neutralizovat kyseliny přijetím protonu. Ve vodném roztoku uvolňuje hydroxidové ionty*. Zásaditý roztok má pH* větší jak 7.
Silná zásada se ve vodě zcela ionizuje, do roztoku se uvolní velké množství hydroxidových iontů*.
Slabá zásada je ve vodě jen částečně ionizována. Pouze některé molekuly zásady se štěpí za vzniku hydroxidových iontů*.