Na stránkách fotolaboratoře se můžete seznámit s chemikáliemi, které jsou použity při navrhování titračních křivek.
Také si zde můžete prohlédnout laboratorní pomůcky používané při titracích.
Naučíte se sestavit titrační aparaturu, změřit přesný objem a připravit odměrné roztoky.
Předpokladem úspěšné práce v chemické laboratoři je dodržování pravidel bezpečnosti práce, laboratorního řádu a znalost zásad první pomoci.
Desatero pravidel bezpečnosti a hygieny práce při acidobazické titraci:

- Dodržujte laboratorní řád.
- Před začátkem vlastní práce se dobře seznamte s pracovním návodem a během práce ho důsledně dodržujte.
- Během práce udržujte neustále pořádek na pracovním stole, používejte jen řádně označené chemikálie.
- Průběh chemického pokusu neustále sledujte.
- Při práci s kyselinami a hydroxidy si počínejte velmi opatrně. Při práci s koncentrovanými kyselinami je třeba používat ochranné pomůcky.
- Kyseliny nalévejte po tyčince, odměřujte odměrným válcem nebo pojistnou pipetou s balónkem.
- Kyseliny ředíme tak, že je přiléváme do vody, nikdy ne opačně.
- Roztoky hydroxidů připravujeme přidáváním hydroxidu do vody po malých částech a za stálého míchání.
- Při poleptání kyselinou důkladně omyjte postižené místo proudem vody a neutralizujte 3% roztokem hydrogenuhličitanu sodného.
- Při poleptání hydroxidem důkladně omyjte postižené místo proudem vody a neutralizujte 3% roztokem kyseliny citrónové.
Chemikálie
Acidobazické titrace jsou založené na reakci mezi kyselinou a zásadou. K indikaci bodu ekvivalence se používají acidobazické indikátory.Kyselina chlorovodíková HCl
 Kyselina chlorovodíková, zvaná též kyselina solná, je silná jednosytná kyselina. Koncentrovaná kyselina chlorovodíková (35% roztok chlorovodíku ve vodě) je čirá bezbarvá kapalina.
Kyselina chlorovodíková, zvaná též kyselina solná, je silná jednosytná kyselina. Koncentrovaná kyselina chlorovodíková (35% roztok chlorovodíku ve vodě) je čirá bezbarvá kapalina.
Silně kyselé prostředí indikuje zabarvení indikátorů. Methyloranž se zabarvila oranžově, methylčerveň červeně, lakmus červeně, bromthymolová modř žlutě a fenolftalein zůstal bezbarvý. Univerzální indikátorový papírek roztok kyseliny chlorovodíkové zbarvuje červeně.
Roztoky kyseliny chlorovodíkové o molární koncentraci 0,05 až 0,2 mol.dm-3 se používají jako odměrné roztoky v acidimetrii. Přípravu odměrného roztoku kyseliny chlorovodíkové si můžete prohlédnout zde
Kyselina octová CH3COOH
 Kyselina octová je slabá jednosytná kyseliny. Koncentrovaná kyseliny octová je čirá bezbarvá, charakteristicky zapáchající kapalina.
Kyselina octová je slabá jednosytná kyseliny. Koncentrovaná kyseliny octová je čirá bezbarvá, charakteristicky zapáchající kapalina.
Slabě kyselé prostředí indikuje zabarvení indikátorů. Methyloranž se zabarvila oranžově, methylčerveň červeně, lakmus červeně, bromthymolová modř žlutě a fenolftalein zůstal bezbarvý. Univerzální indikátorový papírek roztok kyseliny octové zbarvuje oranžově.

8% roztok kyseliny octové známe pod názvem "ocet", který se v kuchyni používá k dochucení pokrmů. Ocet se přibarvuje kulérem, proto je jeho zbarvení nahnědlé.
Hydroxid sodný NaOH
 Hydroxid sodný je bílá pevná látka, dobře rozpustná ve vodě. Roztok hydroxidu sodného je čirý, bezbarvý a silně zásaditý.
Silně zásadité prostředí indikuje zabarvení indikátorů. Methyloranž i methylčerveň se zabarvily žlutě, lakmus a bromthymolová modř modře a fenolftalein fialově. Univerzální indikátorový papírek roztok hydroxidu sodného zbarvuje modře.
Hydroxid sodný je bílá pevná látka, dobře rozpustná ve vodě. Roztok hydroxidu sodného je čirý, bezbarvý a silně zásaditý.
Silně zásadité prostředí indikuje zabarvení indikátorů. Methyloranž i methylčerveň se zabarvily žlutě, lakmus a bromthymolová modř modře a fenolftalein fialově. Univerzální indikátorový papírek roztok hydroxidu sodného zbarvuje modře.
Roztoky hydroxidu sodného o molární koncentraci 0,1 a 0,2 mol.dm-3 se používají jako odměrná činila v alkalimetrii. Přípravu odměrného roztoku hydroxidu sodného si můžete prohlédnout zde.
Hydroxid amonný NH4OH (vodný roztok amoniaku)
 Hydroxid amonný je slabá zásada. Roztok amoniaku ve vodě je čirý a bezbarvý.
Hydroxid amonný je slabá zásada. Roztok amoniaku ve vodě je čirý a bezbarvý.
Slabě zásadité prostředí indikuje zabarvení indikátorů. Methyloranž i methylčerveň se zabarvily žlutě, lakmus a bromthymolová modř modře a fenolftalein fialově. Univerzální indikátorový papírek vodný roztok amoniaku zbarvuje zeleně.
Acidobazické indikátory
Všimli jste si někdy, co se stane s čajem, když k němu přidáte pár kapek citrónu? Podívejte se na video (580 kB). Čaj změní zabarvení.Některé organické látky v závislosti na pH prostředí mění uspořádání dvojných vazeb v molekule a tím dochází k posunu absorpce viditelného světla do jiné oblasti vlnových délek, což my pozorujeme jako změnu zabarvení. Stejným změnám podléhají i acidobazické indikátory:
- Methyloranž přechází z kyselé oranžové formy na zásaditou žlutou v oblasti pH 3,1 - 4,5. přehrát video (444 kB).
- Methylčerveň přechází z kyselé červené formy na zásaditou žlutou v oblasti pH 4,4 - 6,3. přehrát video (427 kB).
- Lakmus přechází z kyselé červené formy na zásaditou modrou. přehrát video (400 kB).
- Bromthymolová modř přechází z kyselé žluté formy na zásaditou modrou v oblasti pH 6,0 - 7,6. přehrát video (542 kB).
- Fenolftalein přechází z kyselé bezbarvé formy na zásaditou fialovou v oblasti pH 8,0 - 9,8. přehrát video (471 kB).
Příprava odměrných roztoků
Příprava odměrného roztoku HCl
 Připravte 250 ml odměrného roztoku HCl o molární koncentraci c = 0,1 mol.dm-3 z koncentrované kyseliny chlorovodíkové (35%, r = 1,1691, M = 36,461 g.mol-1).
Připravte 250 ml odměrného roztoku HCl o molární koncentraci c = 0,1 mol.dm-3 z koncentrované kyseliny chlorovodíkové (35%, r = 1,1691, M = 36,461 g.mol-1).
- Vypočítáme objem 35% HCl potřebný pro přípravu roztoku o c = 0,1 mol.dm-3.
- V odměrném válci odměříme (1) vypočítané množství 35% HCl a přelijeme do kádinky (2) s destilovanou vodou a promícháme.
- Po vychladnutí roztok přelijeme do odměrné baňky (3) o objemu 250 ml a doplníme destilovanou vodou po rysku.
Příprava odměrného roztoku NaOH
 Připravte 250 ml odměrného roztoku NaOH o molární koncentraci c = 0,1 mol.dm-3 (M = 39,997 g.mol-1).
Připravte 250 ml odměrného roztoku NaOH o molární koncentraci c = 0,1 mol.dm-3 (M = 39,997 g.mol-1).
- Vypočítáme hmotnost NaOH potřebnou pro přípravu roztoku o c = 0,1 mol.dm-3.
- Vypočítané množství NaOH rychle navážíme na hodinovém sklíčku (1) na technických vahách.
- Odvážený NaOH opláchneme vodou a postupně přidáváme do kádinky s vodou (2) za stálého intenzivního míchání skleněnou tyčinkou až do rozpuštění.
- Po vychladnutí roztok přelijeme do odměrné baňky (3) o objemu 250 ml a doplníme destilovanou vodou po rysku.
Příprava roztoků - výpočty
Výpočet objemu 35% HCl potřebného pro přípravu 250 ml roztoku o c = 0,1 mol.dm-3 (r = 1,1691, M = 36,461 g.mol-1).
a) Vypočítáme hmotnost HCl:
m (HCl 100%) = n × M = V × c ×M
m (HCl 100%) = 0,25 × 0,1 × 36,461
m (HCl 100%) = 0,912 g
b) Převedeme na hmotnost 35% HCl:
0,912 g HCl ……………………………100%
x …………………………… 35%
x : 0,912 = 100 : 35
x = 2,606 g 35% HCl
c) Vypočítáme objem 35% HCl:
V = m : r
V = 2,606 : 1,1691
V = 2,23 ml
Pro přípravu 250 ml roztoku HCl o c = 0,1 mol.dm-3 je třeba 2,2 ml 35% HCl.
Výpočet hmotnosti NaOH potřebné pro přípravu 250 ml roztoku o c = 0,1 mol.dm-3 (M = 39,997 g.mol-1).
a) Vypočítáme hmotnost NaOH: m (NaOH) = n × M = V × c ×M m (NaOH) = 0,25 × 0,1 × 39,997 m (NaOH) = 1 g b) Protože NaOH obsahuje částečně Na2CO3 a bývá vlhký, připočítáme 10% hmotnosti: 1 g HCl ……………………………100% x ……………………………110% x : 1 = 110 : 100 x = 1,1 g NaOHPro přípravu 250 ml roztoku NaOH o c = 0,1 mol.dm-3 je třeba navážit 1,1 g NaOH.
Laboratorní pomůcky
Základní operací v odměrné analýze je odměřování přesných objemů, k tomu používáme odměrné nádoby. Vlastní titraci provádíme v titrační aparatuře.Odměřování přesných objemů
Měření objemu patří k nejčastějším úkolům v analytické laboratoři, používá se při přípravě roztoků, v odměrné analýze apod.Objem je fyzikální veličina, jejíž jednotkou v soustavě SI je metr krychlový (m3). V chemii se často používá jednotka tisíckrát menší, decimetr krychlový, který je podle definice totožný s vedlejší jednotkou litr (1 dm3 = 1 l) a jednotka milionkrát menší, centimetr krychlový (1 cm3 = 1 ml).
K odměřování objemu kapalin používáme odměrné nádoby.
 Podle způsobu použití rozlišujeme nádoby:
Podle způsobu použití rozlišujeme nádoby:
- kalibrované na dolití označené IN, což znamená, že jestliže se nádoba naplní po značku, obsahuje přesně ten objem kapaliny, který je na ní uvedený.Jsou to například odměrné válce nebo odměrné baňky (viz obrázek).
- kalibrované na vylití označené EX, což znamená, že objem označený na nádobě získáme vylitím kapaliny z nádoby naplněné po danou značku. Jsou to například pipety nebo byrety.
Odměrné nádoby
 Odměrné válce slouží k méně přesnému odměřování kapalin, například k přípravě roztoků, jejichž přesnou koncentraci dále zjišťujeme, popřípadě k ředění roztoků destilovanou vodou před vlastní titrací.
Odměrné válce slouží k méně přesnému odměřování kapalin, například k přípravě roztoků, jejichž přesnou koncentraci dále zjišťujeme, popřípadě k ředění roztoků destilovanou vodou před vlastní titrací.

 Odměrné baňky se používají k přesnému odměřování objemů, pro přípravu zásobních roztoků z navážky vzorku a na přípravu roztoků přesné koncentrace.
Odměrné baňky se používají k přesnému odměřování objemů, pro přípravu zásobních roztoků z navážky vzorku a na přípravu roztoků přesné koncentrace.
Baňky se plní ve svislé poloze pomocí nálevky. Před dolitím kapaliny po značku se nálevka vyjme a zbývající potřebná kapalina se přidává opatrně pipetou. Kapaliny má být tolik, aby se meniskus svým spodním okrajem dotýkal značky, přičemž značka musí být ve výšce očí.
 Pipety se používají k přesnému odměřování malých objemů kapalin.
Pipety se používají k přesnému odměřování malých objemů kapalin.
Nedělené pipety jsou kalibrované na určitý objem, který je uveden na rozšířené střední části pipety.
Dělené pipety jsou opatřeny stupnicí dělenou na cm3 a jejich desetiny popř. setiny.

 Aby odměřování objemu pipetou bylo správné, je třeba ji před použitím propláchnout destilovanou vodou, dále pak odměrným roztokem (odlitým do suché kádinky, nikdy ne ze zásobního roztoku).
Aby odměřování objemu pipetou bylo správné, je třeba ji před použitím propláchnout destilovanou vodou, dále pak odměrným roztokem (odlitým do suché kádinky, nikdy ne ze zásobního roztoku).
Kapalinu nasáváme pomocí pryžového balónku, dokud nevystoupí nad značku. Pipetu nahoře uzavřeme ukazováčkem a mírným uvolněním ukazováčku necháme přebytečnou kapalinu odtéci zpět do nádoby, až je meniskus v rovině kalibrační křivky.
Potom necháme odměrný roztok volně vytéci, nikdy nevyfukujeme zbytek roztoku u špičky pipety.
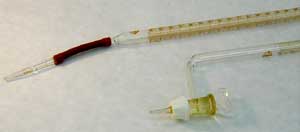 Byrety se používají k přidávání přesného množství kapalin při titracích.
Byrety se používají k přidávání přesného množství kapalin při titracích.
Vyrábějí se nejčastěji pro objemy 5 - 100 cm3 a jsou dělené po 1 cm3, který je ještě rozdělený na desetiny. Objem odečítáme s přesností na 0,05 cm3 (polovina dílku).
Jejich dolní konec je opatřen zabroušeným kohoutkem nebo kuličkovým ventilem (ten používáme pro alkalické roztoky, které mohou způsobit "zapékání" skleněného kohoutku).
Byrety připravujeme podobně jako pipety, propláchnutím malým množstvím roztoku a zároveň zjistíme, zda nám byreta "nepodtéká", podle potřeby potřeme zábrus uzavíracího kohoutku Ramsayovým tukem.
Při měření objemu musí být byrety připevněny ke stojanu svisle a oči musí být ve výšce hladiny.
Titrační aparatura
| Acidimetrie | Alkalimetrie |

|

|
Při titraci držíme titrační baňku v pravé ruce. Za krouživého pohybu baňkou ovládáme druhou rukou kohout byrety. Zpočátku přidáváme roztok rychleji a v blízkosti bodu ekvivalence po kapkách.